Алкены общая. Алкены — номенклатура, получение, характерные химические свойства
Алкены — номенклатура, получение, характерные химические свойства
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
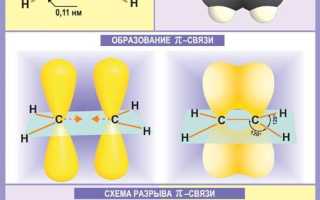
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр 2 -гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты .
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкены. Получение, химические свойства и применение алкенов
Разделы: Химия
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
- рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
- углубить и конкретизировать понятия о ?-связи, о механизмах химических реакций;
- дать первоначальные представления о реакциях полимеризации и строении полимеров;
- разобрать лабораторные и общие промышленные способы получения алкенов;
- продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO4, этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
- Какие углеводороды называются алкенами?
- Каковы особенности их строения?
- В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C8H18 ––> C4H8 + C4H10; (термический крекинг при 400-700 o С)
октан бутен бутан
– дегидрирование алканов C4H10 ––> C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH ––> C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов
– дегидратация спиртов С2Н5ОН ––> С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной – и одной -связи, которая достаточно легко поляризуется.
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.
Запомни! Возможны следующие механизмы разрыва -связи:
а) если алкены и реагент – неполярные соединения, то -связь разрывается с образованием свободного радикала:
б) если алкен и реагент – полярные соединения, то разрыв -связи приводит к образование ионов:
в) при соединении по месту разрыва -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства ( инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C2H4 + 3O2 ––> 2CO2 + 2H2O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
Запомните главное!
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что – связь под действием реагентов легко разрывается.
3. В результате присоединения происходит переход атомов углерода из sp 2 – в sp 3 – гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала
Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Алкены: номенклатура и строение
Выясним, что представляют собой алкены. Номенклатура данного класса имеет некоторые отличительные характеристики, о которых следует упомянуть подробнее.
Особенности класса
У представителей ряда этилена есть исторически сложившееся название – олефины. Оно связано с тем, что их считали родоначальниками олиф (высыхающих натуральных масел). Общая формула всех представителей данного ряда – СпН2п. Среди отличительных параметров выделим наличие двойной связи (непредельный характер).
Специфика названия
Международная номенклатура алкенов предполагает использование определенного алгоритма для наименования олефинов. Какова последовательность действий? Сначала необходимо выделить в углеродном скелете самую длинную углеродную цепочку, включающую в себя двойную связь. Далее нумеруются углеродные атомы, начиная с той стороны, к которой ближе всего располагается двойная связь.
Алгоритм алкенов
При наличии ответвлений (радикалов) необходимо указать их. Как это правильно сделать? Систематическая номенклатура алкенов подразумевает указание цифр, при которых эти частицы располагаются. Кроме того, необходимо учитывать строение и количество радикалов. При присутствии в формуле нескольких одинаковых частиц используют добавочные приставки: ди-, три-, тетра-, пента-, гекса-.
При наличии различных радикалов их наименование осуществляют с учетом русского алфавита. При названии самой углеродной цепочки обязательно применяют суффикс -ен. Какие еще особенности предполагает номенклатура алкенов? Примеры гомологов этилена показывают важность указания положения двойной связи в названии.
Например, для олефина состава С4Н8 возможно существование двух форм: бутена-1 и бутена-2.
Изомерия олефинов
Какие изомеры имеют алкены? Номенклатура данных соединений подробно рассматривается в рамках школьного курса органической химии. Учитывая, что у циклоалканов и олефинов одинаковая общая формула (СпН2п), можно смело утверждать, что представители данных классов углеводородов являются межклассовыми изомерами. Например, с качественным и количественным составом, выраженным формулой С3Н6, может существовать циклопропан и пропен. Кроме этого вида можно рассмотреть и пространственное строение. Изомерия, номенклатура алкенов в этом случае имеет определенные особенности. Предполагается существование двух конфигурационных изомеров: цис- и трансвида.
В первом случае одинаковые заместители должны располагаться в одной области симметрии исходной молекулы. При трансформе предполагается их расположение в противоположных плоскостях. Для олефинов с длинными углеродными цепочками характерна изомерия главной цепи.
Получение алкенов
Изомерия и номенклатура алкенов рассмотрены выше. Теперь выясним способы получения данного класса непредельных углеводородов. В качестве основного промышленного способа получения первых четырех представителей класса олефинов рассматривают пиролиз и крекинг нефтепродуктов. Например, крекинг С4Н10 осуществляют при температуре 600 градусов Цельсия. В смеси продуктов реакции содержится этан, метан, этилен, водород, пропен.
Среди инновационных вариантов получения олефинов выделим каталитическую дегидрогенизацию насыщенных углеводородов, осуществляемую при повышенной температуре.
Лабораторные способы
В лабораторных условиях самым распространенным способом получения представителей гомологического ряда алкенов является отщепление воды от молекул предельных одноатомных спиртов. Данный процесс осуществляется при нагревании алканола с концентрированной фосфорной либо серной кислотой.
Специфику дегидратации третичных и вторичных предельных спиртов можно определить, воспользовавшись правилом Зайцева. Для создания молекулы воды происходит отщепление водорода от углерода, который менее гидрогенизирован.
Кроме того, можно получить олефины и в процессе реакции дегидрогалогенирования. Отщепление молекулы галогеноводорода происходит в случае воздействия на соответствующую галогенопроизводную молекулу спиртовым раствором щелочи.
Физические свойства
Какими физическими свойствами обладают алкены? Номенклатура и изомерия были нами рассмотрены выше, теперь остановимся на физических характеристиках. Олефины состава С2-С4 при нормальных условиях являются газообразными веществами, от пяти до семнадцати углеродных атомов они представляют собой жидкости, а далее являются твердыми веществами.
С возрастанием относительной молекулярной массы веществ наблюдается повышение температуры плавления. Для олефинов характерна минимальная растворимость в воде. Отметим, что в органических растворителях она существенно увеличивается.
Химические свойства
Чем еще характеризуются алкены? Номенклатура класса показывает непредельность их характера. Поэтому в качестве первого химического свойства рассмотрим гидрирование (насыщение водородом). В процессе данной реакции происходит превращение алкена в соответствующий ему насыщенный углеводород. Например, при гидрировании пропена образуется пропан. Каковы условия осуществления данного процесса? Присоединение водорода осуществляется при повышенной температуре, использовании катализатора.
Для олефинов, как и всех других классов органических веществ, характерны реакции окисления. В зависимости от условий, при которых проводится процесс, можно получать различные продукты: спирты, альдегиды, карбоновые кислоты.
На воздухе алкены горят с выделением водяного пара и углекислого газа, причем процесс сопровождается выделением существенного количества теплоты.
Среди специфических реакций, выделяющих представителей данного класса среди других углеводородов, отметим взаимодействие с раствором перманганата калия. Продуктом такого взаимодействия являются двухатомные спирты, называемые гликолями.
Жесткое окисление данным веществом в кислой среде при повышенной температуре приводит к полному разрыву двойной связи, получению кетонов либо кислот.
Применение алкенов
Мы рассмотрели основные свойства, которыми обладают алкены. Номенклатура, количество изомеров у представителей олефинов свидетельствуют о широкой возможности их практического использования.
Они в больших количествах применяются в качестве исходных веществ для производства органических растворителей: дихлорэтана, спиртов. Кроме того, путем синтеза олефинов производят полимерные соединения: полиизобутилен, поливинилхлорид, полиэтилен.
Благодаря повышенной химической активности, объясняющейся присутствием в молекулах двойной связи, этилен используют в производстве двухатомного спирта этиленгликоля. Именно этот продукт необходим для создания синтетического лавсана, изготовления взрывчатых веществ, производства антифризов.
Особое место в современном химическом производстве занимает синтез полиэтилена. В процессе полимеризации образуется вещество, которое является основой изготовления топлива, синтетического каучука, а также разнообразных полимерных материалов.
Протекает подобный процесс при повышенной температуре, применяется катализатор. Если у полиэтилена макромолекулы имеют незначительные размеры, его используют в качестве жидкого смазочного материала. При количестве структурных звеньев в диапазоне от одной до трех тысяч штук полиэтилен востребован в изготовлении пластиковой посуды.
При доведении длины цепи до шести тысяч повторяющихся структурных звеньев изготавливают трубы, различные детали. В процессе полимеризации пропена образуется синтетическое волокно. Химический процесс взаимодействия с хлороводородом этилена сопровождается образованием хлорэтана, применяемого в современной медицине в качестве анестезии.
Способность олефинов вступать во взаимодействие с молекулами воды также нашла свое применение в промышленности. Подобным способом получают из этилена этанол, который не только является основным сырьем для производства алкогольной продукции, но и имеет отличные свойства растворителя.
Олефины востребованы в косметической промышленности, создании лакокрасочной продукции, изготовлении взрывчатых веществ, являются сырьем для уксусной кислоты, ароматических углеводородов.
Источники:
http://himege.ru/alkeny-nomenklatura-poluchenie-xarakternye-ximicheskie-svojstva/
http://urok.1sept.ru/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/507728/
http://www.syl.ru/article/290727/alkenyi-nomenklatura-i-stroenie